Golemo otkriće umjetne inteligencije otvara novu eru u biologiji i medicini
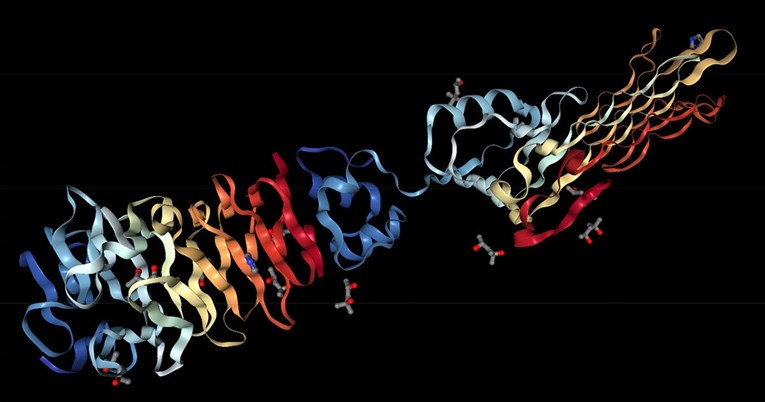
ALPHAFOLD, DeepMindova umjetna inteligencija, uspio je u malo više od godinu dana dešifrirati 3D strukturu oko 200 milijuna proteina, što znači gotovo svih proteina svih poznatih organizama na Zemlji. Ovaj pothvat imat će golem značaj za istraživanja u biologiji i medicini jer će nakon njega određivanje oblika bilo kojeg proteina postati jednostavno kao da ga se traži u Googleovoj tražilici.
Proteini su temelj života
Da bismo razumjeli život, moramo razumjeti proteine. Bića su molekularni strojevi, a većina ključnih komponenti organizama sastoji se od proteina.
Molekularni biolog i genetičar Kristian Vlahoviček, voditelj grupe za bioinformatiku i računalnu biologiju Zavoda za molekularnu biologiju na PMF-u u Zagrebu, kaže da su proteini u pozadini svih procesa koji se odvijaju u našim stanicama, od razgradnje hranjivih tvari do proizvodnje energije, diobe, disanja i obrane stanice.
"Stoga je poznavanje strukture proteina neizmjerno važno u procesu spoznaje kako život funkcionira, kako se svi ti procesi odvijaju na nizovima aminokiselina precizno smotanih na točno određeni način kako bi proteini mogli obavljati svoj posao", rekao je za Index Vlahoviček.
Za ilustraciju, ovaj članak možete čitati zahvaljujući proteinima. Dok neki od njih u mrežnici vašeg oka registriraju svjetlost, neki drugi pokreću mišiće vaših očiju, ruku, prstiju itd.
Proteini su velike molekule koje se sastoje od jednog ili više dugih lanaca aminokiselina. U organizmu obavljaju širok niz funkcija. Među ostalim, omogućuju reagiranje na podražaje, pospješuju, odnosno kataliziraju različite metaboličke reakcije, omogućuju replikaciju DNA, osiguravaju strukture u stanicama, sudjeluju u prijenosu molekula s jednog mjesta na drugo itd. Međusobno se razlikuju prvenstveno po slijedu aminokiselina, koji je određen slijedom nukleotida gena koji obično rezultira savijanjem proteina u specifičnu 3D strukturu koja određuje njegovu aktivnost, odnosno funkciju. Kada znamo kako se protein savija, možemo razumjeti kako funkcionira, ali i kako promijeniti njegovo ponašanje.
Poznavanje proteina ključno je za stvaranje lijekova
Vlahoviček kaže da se većina lijekova veže na proteine i utišava ili pojačava njihovo djelovanje.
"Stoga su često dizajnirani pomoću informacija o strukturama proteina, a njihovi točni 3D modeli često su prvi korak prema razumijevanju kako funkcioniraju, a potom i kako utjecati na njihove funkcije", tumači Vlahoviček.
Donedavno je otkrivanje 3D strukture proteina bilo sporo i mukotrpno
Iako DNA daje upute za stvaranje lanaca aminokiselina, predviđanje kako će one međusobno reagirati da bi stvorile 3D oblik određenog proteina donedavno je bilo vrlo zahtjevno. Znanstvenici su za tu svrhu uobičajeno koristili dugotrajne i skupe metode kao što su rendgenska kristalografija i krioelektronska mikroskopija. Zbog toga su prije ovog golemog pothvata AlphaFolda uspjeli dešifrirati samo djelić od oko 200 milijuna proteina organizama koji su poznati znanosti.
Vlahoviček kaže da se do sada postupak utvrđivanja prostorne strukture proteina uglavnom oslanjao na eksperimentalne metode, a većina pokušaja da se računalima predvidi kako se jednodimenzionalni lanac smata u točno određenu strukturu bila je uglavnom svedena na vrlo jednostavne slučajeve.
"DeepMind je svojim pristupom uspio simulirati taj kompleksni biološki proces do razine na kojoj je moguće poprilično točno predvidjeti prostornu strukturu ogromnog broja proteina, pa čak i onih koji nisu slični već poznatim strukturama, što je do sada bio uvjet pouzdanog predviđanja. Ovo je za znanstvenike izuzetna pomoć jer otvara put ne samo boljem dizajnu lijekova već i spoznajama kako proteini evoluiraju i kako se, u konačnici, doista uživo odvija proces smatanja proteina", objasnio je Vlahoviček.
Podaci će biti besplatno dostupni
Golema datoteka, koja sadrži više od 20 terabajta informacija, bit će besplatno dostupna u bazi podataka koju je uspostavio DeepMind, Googleova tvrtka sa sjedištem u Londonu, koji je razvio AlphaFold u suradnji s Europskim bioinformatičkim institutom (EMBL-EBI) Europskog laboratorija za molekularnu biologiju, međuvladinom organizacijom sa sjedištem u blizini Cambridgea u Velikoj Britaniji.
Izvršni direktor DeepMinda Demis Hassabis rekao je na konferenciji za novinare da se može reći da nova baza podataka pokriva cijeli svemir proteina.
"Uključuje prediktivne strukture za biljke, bakterije, životinje i mnoge druge organizme, čime se otvaraju ogromne nove mogućnosti da AlphaFold utječe na važna pitanja kao što su održivost, nesigurnost u proizvodnji hrane i zanemarene bolesti", rekao je.
"Na početku smo nove ere digitalne biologije", dodao je.
Vrlo precizna predviđanja strukture proteina
AlphaFold kreira vrlo precizna predviđanja 3D oblika proteina i pritom daje informacije o točnosti svojih predviđanja, tako da istraživači znaju na koje se podatke mogu osloniti i u kolikoj mjeri.
Prema EMBL-EBI-ju, oko 35% od više od 214 milijuna predviđanja smatra se vrlo točnim, što znači da su jednako dobra kao eksperimentalno utvrđene strukture. Ostalih 45% smatra se dovoljno sigurnim da se mogu koristiti za mnoge primjene.
Malobrojnija loša predviđanja često su očita, a neka od njih uzrokovana su intrinzičnom neuređenošću u samim proteinima, što znači da oni sami po sebi nemaju definiran oblik, barem bez prisutnosti drugih molekula.
Brojne moguće primjene i lavina novih otkrića
Dostupnost gotovo svih poznatih proteina u jedinstvenoj bazi podataka omogućit će brojna nova istraživanja. Primjerice, ona će se moći koristiti za identificiranje novih vrsta obitelji proteina, za razumijevanje razvoja proteina s korisnim svojstvima, kao što je primjerice sposobnost mikroorganizama da konzumiraju plastiku, ili pak za istraživanje proteina koji mogu biti povezani s nastankom raka ili neke druge bolesti.
Primjena u dizajniranju cjepiva protiv malarije
Primjerice, u svibnju je znanstveni tim pod vodstvom prof. Matthewa Higginsa sa Sveučilišta u Oxfordu objavio da je uz pomoć AlphaFoldovih modela odredio strukturu ključnog proteina parazita malarije te utvrdio mjesto na kojem bi se protutijela mogla vezati kako bi blokirala djelovanje parazita.
"Prije smo koristili tehniku koja se zove kristalografija proteina kako bismo utvrdili kako ta molekula izgleda, no budući da je prilično dinamična i da se kreće, jednostavno se nismo mogli uhvatiti u koštac s njom", rekao je Higgins za Guardian.
"Kada smo uzeli AlphaFold modele i kombinirali ih s eksperimentalnim dokazima, odjednom je sve imalo smisla. Taj će se uvid sada koristiti za dizajniranje poboljšanih cjepiva koja će poticati nastajanje najjačih protutijela koja blokiraju prijenos malarije", dodao je.
Otkrivanje enzima koji razgrađuju plastiku
AlphaFoldove modele također koriste znanstvenici Centra za inovacije enzima Sveučilišta u Portsmouthu kako bi identificirali enzime iz prirodnog svijeta koji bi se mogli prilagoditi za probavu i recikliranje plastike.
"Trebalo nam je dosta vremena da prođemo kroz ovu ogromnu bazu podataka o strukturama, no otkrili smo cijeli niz novih trodimenzionalnih oblika koje nikada prije nismo vidjeli, a koji bi zapravo mogli razgrađivati plastiku", rekao je voditelj istraživanja prof. John McGeehan.
"Ovo je potpuna promjena paradigme. Od sada stvarno možemo ubrzati proces, a to nam pomaže usmjeriti dragocjene resurse na stvari koje su važne."
Ljudi će ipak i dalje ostati važni
Martin Steinegger, računalni biolog s Nacionalnog sveučilišta u Seulu, koji je pomogao u razvoju verzije AlphaFolda, ističe da će znanstvenici ipak vjerojatno i dalje morati sami upravljati AI-jem.
"Ljudi sve više koriste AlphaFold kako bi odredili interakcije proteina, a takva predviđanja nisu u bazi podataka", poručio je.

bi Vas mogao zanimati
Izdvojeno
Pročitajte još
bi Vas mogao zanimati
































 Facebook
Facebook
 Google
Google